發(fā)布時間:2023-08-23 21:45:01 人氣:2830
生物制品設計的基本要求GMP研討會
1、生物制品
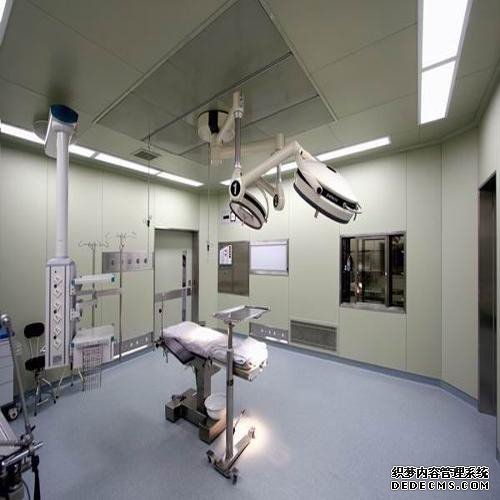
主要參考歐盟和世界衛(wèi)生組織的相關GMP標準和2005年在中國修訂的生物產(chǎn)品附錄草案草案;重點是嚴格控制生產(chǎn)過程和中間過程以及一系列防止污染和交叉污染的要求:有毒作業(yè)區(qū)應有獨立的空調(diào)系統(tǒng);來自病原體操作區(qū)域的空氣不應循環(huán);來自第二類或更高病原體操作區(qū)域的空氣應通過滅菌過濾器排出,并定期檢查過濾器的性能;管理,特別是種子批次,細胞庫系統(tǒng)(原始,主要代,工作)的管理要求以及生產(chǎn)操作和原材料的具體要求。成都手術室凈化公司確保手術臺潔凈度達標,一般多采用垂直層流式效果較好 層流手術室是一個"正壓"環(huán)境,其空氣壓力根據(jù)其不同區(qū)域(如手術間、無菌準備間、刷手間、麻醉間和周圍干凈區(qū)域等)潔凈度不同要求而不同。成都實驗室裝修公司高效安全的手術室空氣凈化系統(tǒng),保證手術室的無菌環(huán)境,可以滿足器官移植、心臟、血管、人工關節(jié)置換等手術所需的高度無菌環(huán)境。采用高效低毒消毒劑,以及合理使用,是保障一般手術室無菌環(huán)境的有力措施。成都手術室裝修公司采用空氣潔凈技術對微生物污染采取程度不同的控制,達到控制空間環(huán)境中空氣潔凈度適于各類手術之要求;并提供適宜的溫、濕度,創(chuàng)造一個潔凈舒適的手術空間環(huán)境。由于手術室要嚴格控制低細菌數(shù)及低麻醉氣體濃度,所以層流超凈裝置的穩(wěn)定性是層流凈化手術室的重要驗收指標。
2、血液制品
參考歐盟相關GMP附錄、我國相關法律法規(guī)、“藥典”標準、2007年血液制品生產(chǎn)整頓實施計劃,關鍵內(nèi)容是確保血液制品原料血漿、中間產(chǎn)品和成品的安全。它涉及原始血漿的再檢驗和檢疫期、供體信息和產(chǎn)品信息的可追溯性、中間產(chǎn)品和成品安全指標的檢查、檢驗、喂養(yǎng)生產(chǎn)、病毒滅活、不合格血漿處理等體外診斷試劑的管理等。
3、無菌藥品
為確保無菌藥物的安全性和質量提供監(jiān)管和科學依據(jù);采用歐盟,世衛(wèi)組織,A,B,C,D等級標準;對無菌藥物生產(chǎn)的清潔度提出了非常具體的要求。 ,動態(tài)監(jiān)測;監(jiān)測浮游細菌,沉淀細菌和表面微生物;完善中型模擬灌裝,滅菌驗證和管理的要求;增加無菌操作的具體要求;加強無菌保障措施。
藥品GMP車間工藝布置應合理、緊湊,有利于生產(chǎn)操作,保證生產(chǎn)過程的有效管理。工藝布置應防止人流與物流的混合和交叉污染,并滿足以下基本要求:
(一)設置進出生產(chǎn)區(qū)的客流通道,必要時設置特殊的出入口,如原材料、輔料(如原料、輔料、生產(chǎn)廢棄物等)。清潔車間的傳動路線應盡可能短。
2.進入清潔生產(chǎn)區(qū)域的人員和材料應有自己的凈化室和設計。凈化室的設定要求與生產(chǎn)區(qū)域的空氣潔凈度水平相適應。
三。生產(chǎn)作業(yè)區(qū)只設置必要的工藝設備和設計。用于生產(chǎn)、儲存的區(qū)域不得作為非職工進入的通道。
4.運輸人員和物資的電梯應分開。電梯不應位于清潔區(qū)域。必要時,應在電梯前安裝鎖閥室或其他措施,以確保清潔區(qū)域的空氣清潔。